La base de tout : les éléments chimiques
Publié par Jérémy Roggy, le 20 janvier 2025 1.2k
Du pullover à l’être vivant en passant par les astres célestes, on peut affirmer une chose : ils sont tous constitués d’éléments chimiques. Un monde sans éléments chimiques est tout bonnement impossible.
Pour les ordonner, les chimistes ont opéré différents types de classements selon leurs propriétés et leurs masses atomiques respectives. Celui qui s’est finalement imposé est la classification de Mendeleïev.

Les éléments sur une même ligne dans la classification de Mendeleïev ont notamment des propriétés similaires (et donc une périodicité de celles-ci, d’où une ligne correspond à une période). La force de sa classification réside également dans la prédiction d’éléments non connus à son époque, symbolisés par des points d’interrogations, mais découvert plus tard. On peut également noter l’absence des gaz nobles (ou rares) de sa classification, ceux-ci ayant été plus tard vers la fin du 19ème siècle, et donc après les travaux de Mendeleïev. Le tableau périodique ci-après est le modèle actuellement utilisé par les chimistes.
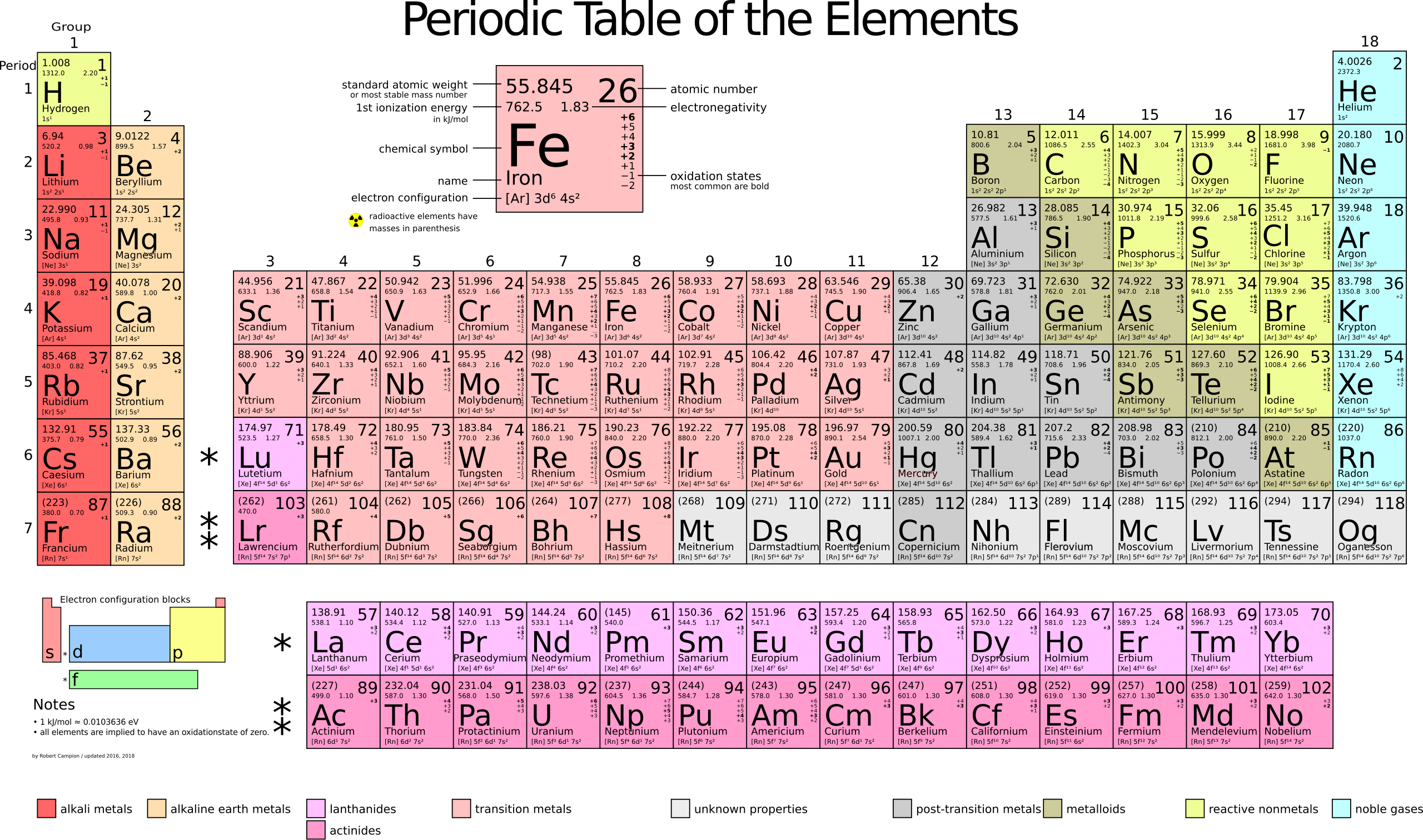
À l’inverse du tableau de Mendeleïev, deux modifications majeures sont à l’œuvre : les éléments chimiques ne sont plus classés selon leur masse atomique mais selon leur numéro atomique, c’est-à-dire leur nombre de protons dans leur noyau, et ils sont également rangés dans des colonnes au lieu de lignes pour les périodes.
On distingue différentes familles d’éléments chimiques, par exemple : les alcalins (période 1), les alcalino-terreux (période 2), les métaux de transitions (périodes 3 à 11), les halogènes (période 17) ou encore les gaz nobles (période 18).
L’intérêt réel du tableau périodique des éléments est qu’il permet de prédire des propriétés physico-chimiques d’un élément, et notamment sa réactivité. Ainsi, dans ce tableau, on trouve le symbole et le nom de l’élément, son nombre de protons qui donne accès à son nombre d'électrons et donc à sa structure électronique, son électronégativité autrement dit sa capacité à attirer les électrons d’un ou d’autres atomes vers lui.
Les lignes du tableau ne sont également pas faites par hasard : leur agencement du haut vers le bas correspond à la structure électronique complète des éléments. Ainsi la première ligne correspond à la structure 1s2, la seconde ligne à la structure 1s2 2s2 2p6, la troisième ligne à 1s2 2s2 2p6 3s2 3p6, et ainsi de suite… En effet, les électrons des atomes sont ordonnés dans des couches électroniques d’énergie différentes : les couches de type s pouvant contenir 2 électrons maximum, celles de type p pouvant en contenir 6, celles de type d avec 10 électrons max, celles de type f avec 14 électrons max.
Prenons l’exemple du carbone (de symbole C) : il possède 6 protons et donc 6 électrons. Sa structure électronique est donc : 1s2 2s2 2p2. Il manque donc 4 électrons sur sa dernière couche pour qu’elle soit saturée et donc pour que l’atome soit stable. Pour y parvenir et donc compléter cette couche, notre atome de carbone va soit se lier à un ou plusieurs atomes, en formant une ou plusieurs liaisons, soit récupérer des électrons libres pour former un ion.
Ces électrons de l’atome de carbone sont présents autour du noyau, non pas sous la forme d’orbites planétaires, mais sous la forme d’orbitales atomiques, c’est-à-dire des orbitales caractérisées par une probabilité de présence de l’électron proche de 100%.
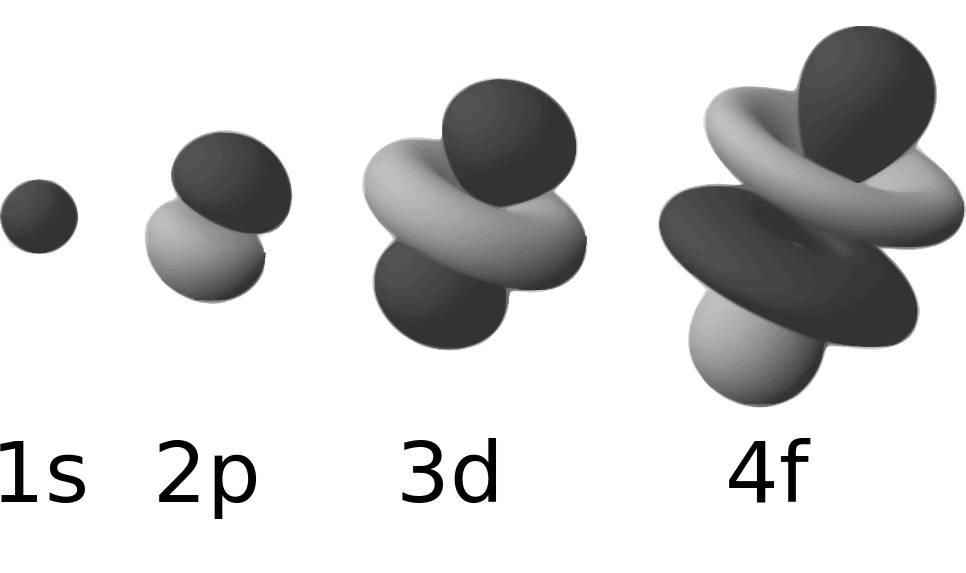
Ces orbitales ont des niveaux d’énergie différents. C’est le jeu d’interactions énergétiques entre les orbitales d’atomes différents qui conduit à la formation de molécules. Ce sera le sujet d’un futur article à ce propos.
À suivre…

