CATALOGUE - ANIMATIONS - Sciences du vivant - Ecole de l'ADN Nouvelle - Aquitaine, Poitiers
Publié par emmanuelle TIENNAULT, le 4 mai 2017 3.8k
Contact : Laurent Fillion,
Directeur de l'Ecole de l'ADN en Nouvelle-Aquitaine, Poitiers.
05 49 50 33 08 — laurent.fillion@emf.fr
ADN ? Élémentaire mon cher Watson

animation — Une initiation aux mystères du vivant avec préparation d'ADN et observations microscopiques.
-
Objectifs :
- Mettre en place un protocole expérimental
- S’initier à l'utilisation du matériel de laboratoire
- Mettre en œuvre des techniques de microscopie
- Observer différents types cellulaires
- Préparer de l’ADN à partir de cellules prélevées dans la salive
- Echanger sur l'unité et la diversité du monde vivant
-
Déroulement :
- A partir d'une définition consensuelle du vivant, les élèves s'engagent dans l'observation microscopique de différents types de cellules.
- De l'ADN est ensuite préparé à partir de cellules buccales.
- L'observation de notre propre ADN nous conduit à échanger sur l'importance de cet immense filament contenu dans chacune de nos cellules ...
- Public : 11 - 12 ans Sixième, 12 - 13 ans Cinquième, 13 - 14 ans Quatrième, 14 - 15 ans Troisième, Cycle 3 (CM1-CM2-6ème)
- Effectif : 12 participants maximum — Durée : 1h30 à 2h
ADN, base d’un cluedo moléculaire

animation — Mademoiselle Rose ou le colonel Moutarde ? Une enquête ludique avec empreintes génétiques.
-
Objectifs :
- S’initier à l'utilisation du matériel de laboratoire et mettre en œuvre des techniques de biologie moléculaire : mise en œuvre du protocole expérimental, digestion de l’ADN de différents individus par des enzymes de restriction, électrophorèse & analyse des profils génétiques
- Echanger sur les enjeux des biotechnologies : tests ADN, tests de paternité et loi de bioéthique, Fichier national automatisé des empreintes génétiques…
-
Déroulement :
- Les participants reçoivent des échantillons d'ADN inconnu qu'ils analysent et comparent avec un ADN de référence, identifié comme celui d'un suspect impliqué dans une procédure judiciaire.
- L'atelier peut également illustrer des sujets autres tels que l'identification variétale ou la phylogénie moléculaire.
- Public : 14 - 15 ans Troisième, Lycée
- Effectif : 16 participants maximum — Durée : 2h
Bactéries et résistance aux antibiotiques
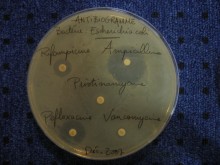
animation — Un atelier pour comprendre la nécessaire adaptation des bactéries et l’utilisation raisonnable des traitements antibiotiques.
-
Objectifs :
- Mettre en œuvre un protocole expérimental et manipuler individuellement
- Emettre des hypothèses expérimentales et les vérifier grâce aux résultats de ses expérimentations
-
Déroulement :
- Les participants reçoivent différents tubes contenant une souche de bactéries sensible à un antibiotique, tubes dans lesquelles ils introduisent un nouveau caractère pour les rendre résistantes (transformation bactérienne).
- Les bactéries devenues résistantes à l’antibiotique sont sélectionnées sur un milieu de culture adapté.
- Des antibiogrammes sont par ailleurs observés pour comprendre et faire le lien entre la sensibilité des bactéries aux antibiotiques et l’acquisition de résistance.
- La discussion peut alors être engagée sur l’utilisation adaptée d’un traitement antibiotique.
- Public : 14 - 15 ans Troisième, Lycée
- Effectif : 16 participants maximum — Durée : 2h
Cellule, chromosomes et caryotype
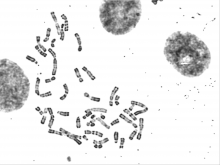
animation — Le caryotype, photographie de l’information génétique cellulaire permet de détecter certaines anomalies chromosomiques ou d’identifier certains caractères du génome d’un individu.
-
Objectifs :
- Observer successivement des cellules, noyaux et chromosomes en microscopie photonique
- Réaliser une coloration au Giemsa de chromosomes humains issus de différents individus
- Analyser différents caryotypes humains – féminin/masculin, trisomie 21, Klinefelter - et faire le lien entre chromosomes et caractères
-
Déroulement :
- Les participants réalisent différentes préparations microscopiques afin d’observer des cellules et mettre en évidence le noyau, puis les chromosomes.
- Cette approche permet d’une part de faire le lien entre la cellule et la localisation du programme génétique, d’autre part de comprendre que les chromosomes ne sont visibles qu’à un moment précis de la vie de la cellule.
- Public : 14 - 15 ans Troisième, Lycée
- Effectif : 16 participants maximum — Durée : 2h
De la mutation à la pathologie
animation — Transmis de génération en génération, sans cesse lu et recopié, l'ADN de vos cellules est soumis à rude épreuve. Quelques modifications peuvent alors se glisser dans la recette... Moteur de notre évolution, ces erreurs peuvent également être à l'origine de sévères pathologies.
-
Objectifs :
- S’initier à l'utilisation du matériel de laboratoire et mettre en œuvre des techniques de biologie moléculaire : mise en place du protocole expérimental, digestion par des enzymes de restriction de l'ADN provenant d’individus sains et malades, électrophorèse, analyse des profils et recherche du type de mutation impliqué dans la myopathie étudiée.
- Étudier la transmission à partir d’un d’arbre généalogique.
- Échanger des points de vue sur les maladies génétiques et leur transmission, les diagnostics moléculaires et leur utilisation, le diagnostic pré-implantatoire, les lois de bioéthique…
-
Déroulement :
- Les participants reçoivent de l'ADN d’individus sains ou atteints de dystrophie musculaire de Duchenne (DMD) et étudient la présence d’une mutation particulière sur le gène de la dystrophine (protéine impliquée dans la DMD).
- L'exemple de cette maladie génétique permet d'illustrer une pathologie génétiquement transmissible liée à la modification d'un seul gène.
- L'atelier conduit à un échange sur l'origine moléculaire des maladies génétiques et sur les moyens actuels de diagnostic, sans oublier les problèmes de déontologie et d'éthique qu'ils évoquent.
- Public : Lycée
-
Effectif : 16 participants maximum — Durée : 2h
Invisible biodiversité
 animation — Une découverte de mondes microscopiques grouillant de vie.
animation — Une découverte de mondes microscopiques grouillant de vie.
-
Objectifs :
- S’initier à l'utilisation du matériel de laboratoire
- Mettre en œuvre des techniques de microscopie
- Observer les micro-organismes vivants dans différents milieux
- Échanger sur l'unité et la diversité du monde vivant
-
Déroulement :
- Les participants réalisent des observations microscopiques à partir de différents milieux (eau de rivière, eau de mare, mousse…) afin de découvrir la diversité des êtres vivants, invisibles à l’œil nu, que l’on peut y trouver.
- Un livret permet d’orienter leurs observations en ayant comme objectif d’identifier certains de ces êtres vivants.
- Public : 11 - 12 ans Sixième, 12 - 13 ans Cinquième, 13 - 14 ans Quatrième, 14 - 15 ans Troisième, Cycle 3 (CM1-CM2-6ème)
- Effectif : 12 participants maximum — Durée : 1h30 à 2h
L’ADN au scalpel
 animation — Véritables petits ciseaux moléculaires, les enzymes de restriction permettent de découper l'ADN à façon...
animation — Véritables petits ciseaux moléculaires, les enzymes de restriction permettent de découper l'ADN à façon...
-
Objectifs :
-
Objectifs :
- Comprendre le rôle déterminant des enzymes de restriction dans le développement de la génétique.
- S’initier à l'utilisation du matériel de laboratoire et mettre en œuvre des techniques de biologie moléculaire : digestion d’ADN par des enzymes de restriction, étude du polymorphisme par électrophorèse, exploitation et analyse des résultats.
-
Déroulement :
- Les élèves travaillent sur de l’ADN plasmidique qu'ils vont découper de façon très précise grâce à des enzymes de restriction.
- Les fragments d'ADN obtenus sont alors analysés et visualisés par électrophorèse.
- L’atelier se termine par une discussion sur diverses applications liées à la découverte de ces scalpels moléculaires : empreintes génétiques, diagnostics de maladies génétiques, transgénèse...
- Public : Lycée
-
Effectif : 16 participants maximum — Durée : 2h
Les gènes n’expliquent pas tout…
 animation — Rose,
rouge, bleu, violet… les hortensias de nos jardins offrent une large
palette de couleur. Comme pour de nombreux caractères, cette couleur est
le fruit d’interactions entre les gènes de l’hortensia – son génotype -
et l’environnement.
animation — Rose,
rouge, bleu, violet… les hortensias de nos jardins offrent une large
palette de couleur. Comme pour de nombreux caractères, cette couleur est
le fruit d’interactions entre les gènes de l’hortensia – son génotype -
et l’environnement.
-
Objectifs :
- S’initier à l'utilisation du matériel de laboratoire et mettre en œuvre des techniques de biologie moléculaire : mise en place du protocole expérimental, digestion de l’ADN des différents hortensias par des enzymes de restriction, électrophorèse et analyse des profils génétiques.
- Échanger des points de vue quant à l’importance de l’environnement sur les caractéristiques phénotypiques des êtres vivants, la variabilité des espèces et la sélection variétale, la protection du vivant.
-
Déroulement :
- Les participants travaillent sur l'ADN de différents hortensias et identifient les variétés sur la base de leurs profils génétiques.
- L’analyse des résultats obtenus permet de comprendre les notions et les relations entre génotype, phénotype et environnement.
- L’atelier conduit à un échange sur l’utilisation actuelle de la biologie moléculaire dans la caractérisation et la certification d’espèces ainsi que sur la protection des variétés végétales.
- Public : Lycée
- Effectif : 16 participants maximum — Durée : 2h
Microbes au quotidien
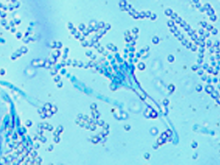 animation — Un atelier pour s’initier à l’infiniment petit et découvrir l’utilité de certains micro-organismes dans notre alimentation.
animation — Un atelier pour s’initier à l’infiniment petit et découvrir l’utilité de certains micro-organismes dans notre alimentation.
-
Objectifs :
- Réaliser des observations microscopiques et les restituer sous la forme de dessins
- Appréhender la diversité des micro-organismes observés
- Faire le lien entre la présence des micro-organismes dans les aliments et la transformation biologique
-
Déroulement :
- À partir de l’étude d’un plateau composé de divers aliments, les participants recherchent ceux fabriqués grâce à l’intervention de micro-organismes.
- Ils réalisent ensuite des observations microscopiques pour trouver moisissures, levures et autres bactéries présentes dans ces aliments.
- Cet atelier illustre l’importance de la présence de micro-organismes dans la transformation contrôlée par l’homme pour la fabrication de certains aliments.
- Public : 11 - 12 ans Sixième, 12 - 13 ans Cinquième, 13 - 14 ans Quatrième, 14 - 15 ans Troisième, Cycle 3 (CM1-CM2-6ème)
- Effectif : 12 participants maximum — Durée : 1h30 à 2h
OGM les reconnaître
 animation — L'Union
européenne a imposé que tous les produits alimentaires contenant plus
de 0,9% d'OGM ou de produits dérivés d’OGM soient étiquetés.
animation — L'Union
européenne a imposé que tous les produits alimentaires contenant plus
de 0,9% d'OGM ou de produits dérivés d’OGM soient étiquetés.
-
Objectifs :
- S’initier à l'utilisation du matériel de laboratoire
- Mettre en œuvre des techniques de biologie moléculaire : mise en place du protocole expérimental, préparation des échantillons d’ADN, réaction de PCR, électrophorèse et analyse des résultats
- Échanger sur la détection des OGM, les possibilités techniques, les difficultés de mise en œuvre à l’échelle d’une filière
-
Déroulement :
- Les participants travaillent sur des échantillons - farine ou ADN - provenant de grains de maïs transgénique ou non (MON 810).
- Par une technique d’amplification de gènes (PCR), ils étudient la présence éventuelle d’un gène étranger qui confère au maïs une résistance à un insecte.
- L’atelier permet de découvrir une méthode standard de détection d’OGM couramment utilisée dans les filières alimentaires.
- La discussion peut alors être engagée sur la sensibilité de la détection, les échanges entre opérateurs au sein d’une filière, les notions de seuil de tolérance et de présence fortuite d’OGM…
- Public : Lycée
- Effectif : 16 — Durée : 2 X 2h
OGM, mode d’emploi
 animation — De la bactérie à la souris, en passant par le maïs, comment l’homme s’est-il lancé dans le transfert de gènes ?
animation — De la bactérie à la souris, en passant par le maïs, comment l’homme s’est-il lancé dans le transfert de gènes ?
-
Objectifs :
- S’initier à l'utilisation du matériel de laboratoire et mettre en œuvre des techniques de biologie moléculaire : mise en place du protocole expérimental, préparation des bactéries, transformation par choc thermique et ensemencement
- Échanger sur la transgénèse & ses applications, les différents types d’OGM, l’importance du clonage en biotechnologie
-
Déroulement :
- Les participants reçoivent des bactéries Escherichia coli (classe I) auxquelles ils vont apporter un nouveau caractère par transgénèse.
- Ces bactéries génétiquement modifiées sont sélectionnées et analysées. L’atelier illustre le transfert de gènes et permet de bien comprendre le lien entre gène et protéine (production de protéine fluorescente).
- La discussion peut alors être engagée sur les applications liées à la transgénèse ainsi que sur les intérêts et les risques liés à l’utilisation d’organismes génétiquement modifiés.
- Public : Lycée
- Effectif : 16 participants maximum — Durée : 2h
OGM, usine à façon
 animation — Insuline,
antibiotiques, bon nombre de vaccins et de très nombreux additifs pour
l’industrie alimentaire proviennent de bactéries ou de levures
génétiquement modifiées.
animation — Insuline,
antibiotiques, bon nombre de vaccins et de très nombreux additifs pour
l’industrie alimentaire proviennent de bactéries ou de levures
génétiquement modifiées.
-
Objectifs :
-
Objectifs :
- S’initier à l'utilisation du matériel de laboratoire et mettre en œuvre des techniques de biologie moléculaire : mise en place du protocole expérimental, extraction protéique et purification sur colonne
- Échanger sur la production de protéines d’intérêt issues du génie génétique
-
Déroulement :
- Les participants extraient, puis purifient une protéine fluorescente (GFP, produite en grande quantité par des bactéries transgéniques
- L’atelier permet de découvrir une méthode standard de détection d’OGM couramment utilisée dans les filières alimentaires.
- C’est aussi un temps d’échange, plus spécifiquement sur l’utilisation de micro-organismes génétiquement modifiés dans divers secteurs d’activité dont l’industrie agroalimentaire, pharmaceutique ou chimique.
-
Prérequis pédagogiques :
- Il est fortement conseillé d'avoir suivi l'atelier "OGM, mode d'emploi".
- Public : Lycée
-
Effectif : 16 participants maximum — Durée : 2h
Un génome commun, des individus différents – Version 1 – polymorphisme génétique
 animation — En
examinant seulement une dizaine de régions du génome humain, une carte
d'identité unique peut être réalisée pour chaque individu.
animation — En
examinant seulement une dizaine de régions du génome humain, une carte
d'identité unique peut être réalisée pour chaque individu.
-
Objectifs :
- S’initier à l'utilisation du matériel de laboratoire et mettre en œuvre des techniques de biologie moléculaire : mise en place du protocole expérimental, préparation d’ADN, réaction de PCR, électrophorèse & analyse de la diversité génétique du groupe
- Échanger des points de vue sur les tests « ADN », les tests de paternité et la loi de bioéthique, le fichier national automatisé des empreintes génétiques…
-
Déroulement :
- Les élèves travaillent sur l'ADN de leurs propres cellules épithéliales.
- Par une technique d'amplification de gène (PCR), ils analysent la région D1S80 de leur génome composée d'un motif de quelques nucléotides répété plus ou moins en fonction des individus.
- A l'échelle du groupe, la forte variabilité de cette région permet d'illustrer la diversité génétique entre individus d'une même espèce.
- La discussion peut alors être engagée tant sur l'exploitation des empreintes génétiques par la police scientifique que sur l'utilisation commerciale des données génétiques, ou bien encore sur l'évolution et la nouvelle classification des espèces en fonction de leur génome.
- Cet atelier peut également illustrer le diagnostic par PCR de maladies neuro-dégénératives telles que la chorée de Huntington (répétition de triplets).
- Public : Lycée
- Effectif : 16 participants maximum — Durée : 2 X 2h
Un génome commun, des individus différents – Version 2 – Variabilité allélique
 animation — L’examen
de petites séquences d’ADN récemment insérées dans notre génome,
présentes chez d’autres primates, permet d’aborder les notions
d’homozygotie et de comprendre l’impact variable de mutations.
animation — L’examen
de petites séquences d’ADN récemment insérées dans notre génome,
présentes chez d’autres primates, permet d’aborder les notions
d’homozygotie et de comprendre l’impact variable de mutations.
-
Objectifs :
-
Objectifs :
- S’initier à l'utilisation du matériel de laboratoire et mettre en œuvre des techniques de biologie moléculaire : mise en place du protocole expérimental, préparation d’ADN, réaction de PCR, électrophorèse & analyse de la diversité génétique du groupe
- Échanger des points de vue sur les tests « ADN », les tests de paternité et la loi de bioéthique, le fichier national automatisé des empreintes génétiques…
-
Déroulement :
- Les élèves travaillent sur l'ADN de leurs propres cellules épithéliales.
- Par une technique d'amplification de gène (PCR), ils analysent une région de leur génome où s’est éventuellement insérée – au cours du dernier million d’années – une séquence d’ADN (séquence Alu).
- La discussion peut alors être engagée tant sur l’évolution et l’innovation génétique que sur le diagnostic de certaines maladies génétiques ou bien encore la plasticité du génome.
- Cet atelier peut également illustrer le diagnostic par PCR de la mutation deltaF508 à l’origine de 70% des cas de mucoviscidose.
- Public : Lycée
- Effectif : 16 participants maximum — Durée : 2 X 2h

